Divergent syntheses of new artificial glutamate analogs
中枢神経シナプス後終末にてイオンチャネル型グルタミン酸受容体(iGluR)は興奮性の神経伝達を担っている。iGluRはリガンド結合ドメイン(LBD)を有しており、リガンドが結合することにより機能を発現することが明らかになっているが、分子レベルでの詳細なメカニズム解明には至っていない。
IKM–159は海洋性由来の天然物であるダイシハーベインとカイニン酸をモチーフに当研究室で人工的に開発された化合物で、生物活性試験ではマウスの自発的行動を抑制した(Scheme 1)。電気生理学的手法を用いたin vitro試験では、AMPA受容体をサブタイプ選択的に阻害することが発見された。IKM–159(6員環アミン)のC環部類縁体であるTKM–107(7員環アミン)3、MC–27(6員環エーテル)も同様にin vivo試験において抑制性の活性を示した。一方でC環部に7員環エーテルを有するIKM–154は興奮性の活性を示した。このようにIKM–159類縁体にはC環部の構造によって活性が変化するユニークな特徴がある。また、天然物は2S体が活性体であるが、IKM系の化合物は2R体のみが活性エナンチオマーであった。そこで、本研究では8員環アミンを有する新規類縁体の(2R)–TKM–38 (1)を不斉合成し、活性試験を行うことでAMPA受容体との構造活性相関を調べることを目的の一つとした。
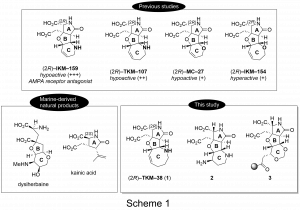
また、(2R)–IKM–159はAMPA受容体との共結晶X線構造解析に成功しており、LBDに結合していることが確認されている。しかし、トリチウム標識されたAMPAを用いた放射性リガンド結合法ではIKM–159がLBDに結合する様子が確認されず、アロステリックな部位に結合している可能性を残している。そこで、本研究ではAMPA受容体と共有結合可能な光親和性標識基を導入することができる、IKM–159のC環部類縁体2と3を合成することを二つ目の目的とした。
本研究では、(2R)–TKM–38 (1)、2、3の合成には同じオキサノルボルネン4を出発物質とした多様性志向型の合成手法を用いることとした。オキサノルボルネン4はタンデム型四成分縮合反応により合成できる。また、合成終盤のホモアリルアルコール7には様々な官能基を導入することができ、効率的にジオキサン骨格を有した複数類縁体を合成することができる(Scheme 2)。
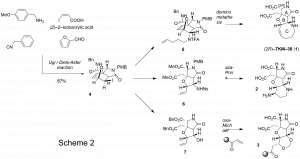
(2R)–TKM–38 (1)の合成
オキサノルボルネン4に常法を用いてN–pentenyl TFA amide基を導入した(Scheme 3)。続いてドミノメタセシス反応により、8員環を形成し三環性化合物8を収率64%で合成した。続く3段階の官能基変換により得られたラセミ体のカルボン酸9にキラルアルコールを用いた椎名エステル化を行うことでジアステレオマー混合物へと誘導し、HPLCを用いて10を単離した。残った保護基を2段階の反応で全て除去し、最終的に26 mgの(2R)–TKM–38 (1)の合成に成功した。総収率は(Z)–2–iodoacrylic acidから10段階で1.9%であった。(2R)–TKM–38を5 mg/mLの濃度でマウスの脳室内に10 uL投与したが、活性が確認されなかった。6員環アミン(IKM–159)は強い抑制性、7員環アミン(TKM–107)はやや弱い抑制性、8員環アミン(TKM–38)は活性が無かったことから、環のサイズが大きくなるにつれ活性が弱くなることが分かった。現在、より強い活性が期待される5員環アミン類縁体を不斉合成することを検討中である。
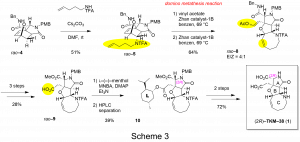
グルタミン酸類縁体2の合成(アザプリンス反応を用いて)
オキサノルボルネン4にNsNH2をカップリングさせN–Nsアミド11を合成し、メタセシス反応を行うことで二環性骨格を構築した(Scheme 4)。続く4段階の官能基変換によりホモアリルアミン6へと誘導し、アザプリンス反応を試みた。しかし、TMSIやNaI、MsOH、TsOH等の求核試薬や反応条件をスクリーニングしたが、ピペリジン骨格を構築することができなかった。反応が進行しなかった理由としてNs基の立体障害が考えられるので、保護基の検討を今後行っていきたい。また、ここで得られたホモアリルアミン6からは2段階の反応で上述の5員環アミンを構築できることが期待されている(反応式省略)。
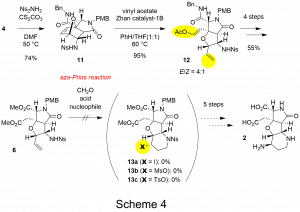
グルタミン酸類縁体3の合成(オキサマイケル反応を用いて)
オキサノルボルネン4を出発原料として既存の合成ルート5を用いることで、既知のホモアリルアルコール14を7段階で合成した(未発表のため構造式は非公開)。続いてメチルビニルケトン存在下でHoveyda–Grubbs触媒を作用させることで、エノン15を得た。次にオキサマイケル反応を行ったところ、望みのジオキサン骨格を有したアミド16をN–ヒドロキシメチル体17との混合物として得ることに成功した。最後にジメチルエステル16/17の混合物に対してアルカリ加水分解を試みたが、C環部の巻き直しが起きて望みではないグルタミン酸類縁体TKM–15が生じた。塩基によりケトンのα位のプロトンが引き抜かれたことが原因であると考え、最終脱保護で塩基を使わなくて良いBn基に保護基を変えることにした。ジメチルエステル14を6M塩酸で処理した後、BnBrを作用させることで、ジベンジルエステル7を得た。続いて先ほどと同様にメタセシス反応を行うことで、エノン18aを得た。これにオキサマイケル反応を行った後に、生じたN–ヒドロキシルメチル副生成物をアンモニア水で処理することで、ジオキサン19aを合成することに成功した。最後に残ったジベンジルエステルに接触水素化を行うことで、新規グルタミン酸類縁体TKM–50 (3a)の合成を達成した(計14段階、総収率12%)。また、ホモアリルアルコール7に対してオクテノンや4–メトキシフェニルビニルケトンを導入し、オキサマイケル反応を行うことで、対応するジオキサン19bと19cを得ることにも成功し、直鎖の脂肪族や芳香族化合物に対しても本反応を適用できることを示せた。それぞれ、脱保護することで、TKM–86(3b、計14段階、総収率8.8%)とTKM–99(3c、計14段階、総収率1.7%)と名付けた類縁体も合成した。
TKM–50を5 mg/mLの濃度でマウスの脳室内に10 uL投与し、効果を観察した(未発表のため詳細は非公開)。このように、本研究ではC7位に置換基を持った活性のあるグルタミン酸類縁体の合成に成功したので、現在はこの位置に光親和性標識基を導入することを検討している。
参考文献
- M. B. Gill et al., Br. J. Pharmacol., 2010, 160, 1417-1429.
- M. Oikawa et al., J. Synth. Org. Chem. Jpn., 2020, in press.
- S. Tsukamoto et al., Heterocycles, 2020, 101, 91-98.
- L. Juknaite et al., J. Med. Chem., 2013, 56, 2283-2293.
- M. Chiba et al., Bioorg. Med. Chem. Lett., 2015, 25, 1869-1871.


