中枢神経シナプスは興奮と抑制性神経伝達の絶妙なバランス(I/Eバランス)が保たれることで恒常性が担保されており、その乱れは神経因性疼痛、うつ、てんかん、片頭痛などさまざまな神経症状に波及します。I/Eバランスは興奮性および抑制性のイオンチャネル型受容体に加え多くの代謝調節型受容体の複雑な相互作用の上に成り立っていますが、そのメカニズムについてはわかっていないことが多くあります。この研究を困難にしているのは、関与する受容体の構造多様性です。例えば興奮性神経伝達を担うイオンチャネル型グルタミン酸受容体 (iGluR) は、哺乳類においては18の遺伝子にエンコードされており、それらは親和性の高いリガンドにちなみ4つのファミリー(AMPA受容体、カイニン酸受容体、その他)に分類されています。AMPA受容体には4つのサブユニットタンパク質 (GluA1~GluA4)があって興奮性シナプス後電流 (EPSC) を司り、また、シナプス前/シナプス後の両方に存在するカイニン酸受容体には5つのサブユニットタンパク質 (GluK1~GluK5) があります。これらサブユニットタンパク質はホモあるいはヘテロメリックに四量化してiGluRを形成し、構造的に多様化しています。「わかっていないことが多くあります」と前述しましたが、大まかには、AMPA受容体は速い神経伝達を担い記憶や学習機能の中心にあるのに対し、カイニン酸受容体は中枢神経系の興奮と抑制のバランスを調節する役割を担っているということはわかっています。脳機能をより詳細に分子のレベルで理解するため、このiGluRに対するさまざまなリガンド化合物が開発されてきました。その中には医療に用いられるものもあります。
私たちは、2008年にAMPA受容体の阻害剤IKM-159の開発に成功して以来1)、生理学的解析と構造生物学的解析を通してその作用メカニズムの研究を進めてきました(図1)2), 3)。IKM-159は内在性の興奮性アミノ酸リガンドであるグルタミン酸の構造を分子内に有します。グルタミン酸は (S)-配置ですが(図2)、IKM-159は (R)-配置であること、そしてIKM-159は抑制性を示すことが特徴です。これはいわゆる「新たな生理活性の創出のための配座固定」と呼ばれる手法で、環構造をアクセサリーとして導入し、アミノ基の立体配置を反転させることにより開発を実現しました。
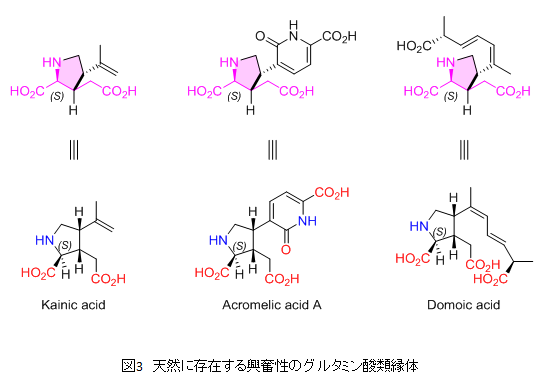
天然界にもこのような配座固定グルタミン酸が存在します(図3)。興味深いことにこれらはいずれも興奮性です。人工化学合成により抑制性のIKM-159を見出すことができたことは極めて意義が大きいと私たちは考えています。
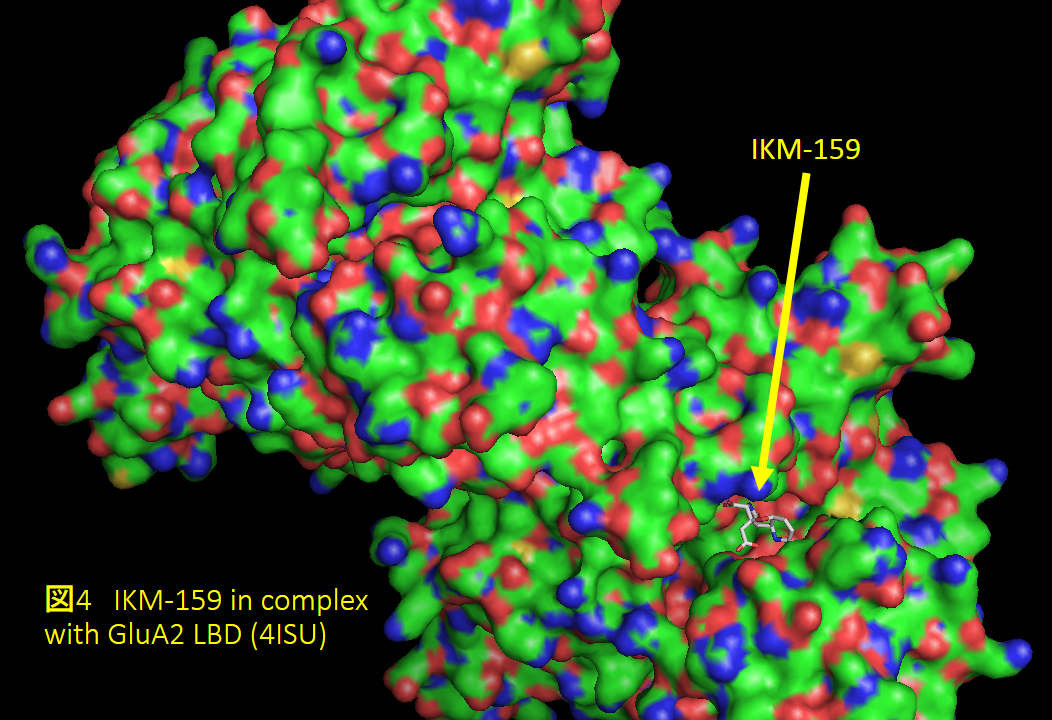
私たちはIKM-159の研究を進め、2013年には共同研究者とともにAMPA受容体サブユニットタンパク質のひとつGluA2のリガンド結合ドメインとIKM-159の複合体の構造解析に成功しています(図4)3)。
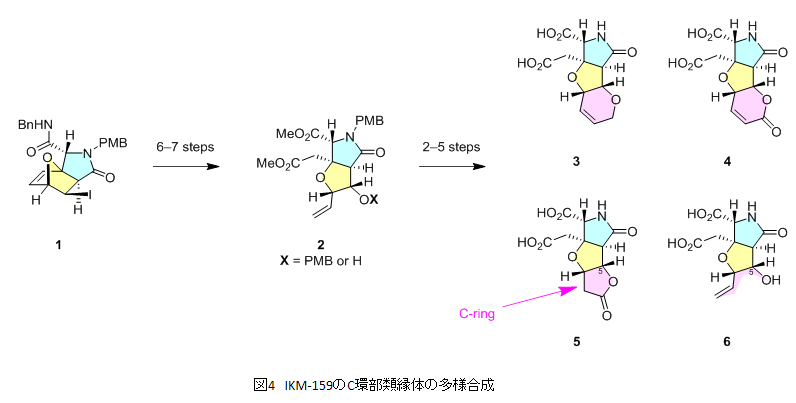
以上の知見を元に、2013年から2014年にかけてはIKM-159のC環に構造多様性を与えうる合成経路の開発に取り組みました(図4)4)。4成分を縮合させるUgi / Diels-Alder反応により容易に得られるオキサノルボルネン1を出発原料とし、6〜7段階の反応により共通中間体2を得ました。この化合物の開発には半年を要しましたが、これを足がかりとしてC環部の構造の異なる類縁体3〜6をわずか3ヶ月で合成しました。さらに共通中間体2からは別の反応により7種類縁体の合成にも4ヶ月で成功しています(構造式は省略)。
類縁体3〜6は「C5位オキサ類縁体」と名付け、共同研究者とともにマウス脳室内投与試験を実施しました。その結果、C環を取り除いたり、あるいはカルボニル基を導入したりした化合物4〜6の場合において活性の顕著な消失が認められました。一方、IKM-159のC環窒素を酸素に置き換えた類縁体3においては微弱ながらも行動抑制活性が保持されていました。これらのことから、C環部が存在していること、そしてヘテロ元素が形成する官能基がIKM-159のin vivo活性に重要な役割を果たしていることが示されました。
2014年度は IKM-159の抑制活性のための構造要請に関し以上のような知見を得ることができました。加えて、上述したように7種類縁体の開発にも成功しており、それらのin vivo活性評価も進めています(詳細は省略)。2015年度以降は、IKM-159とGluA2との複合体構造の解析を利用してリガンドデザインにも取り組んでいく予定です。
参考文献
- M. Ikoma, M. Oikawa, et al, Eur. J. Org. Chem., 2008, 5215-5220 (DOI: 10.1002/ejoc.200800704).
- M. B. Gill, S. Frausto, M. Ikoma, M. Sasaki, M. Oikawa, R. Sakai, G. T. Swanson, Br. J. Pharmacol., 2010, 160, 1417-1429 (DOI: 10.1111/j.1476-5381.2010.00784.x).
- L. Juknaitė, Y. Sugamata, K. Tokiwa, Y. Ishikawa, S. Takamizawa, A. Eng, R. Sakai, D. S. Pickering, K. Frydenvang, G. T. Swanson, J. S. Kastrup, M. Oikawa, J. Med. Chem., 2013, 56, 2283–2293 (DOI: 10.1021/jm301590z).
- M. Chiba, C. Fujimoto, R. Sakai, M. Oikawa, Bioorg. Med. Chem. Lett., 2015, 25, 1869–1871 (DOI:10.1016/j.bmcl.2015.03.037).